حلول أسئلة الصف الثالث المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى في موقع موقع سبورة - طلاب السعودية
مراجعة الفصل السابع
قارن بين كل زوجين من المصطلحات الآتية:
1. أيون - جزيء
الأيون ذرة مشحونة، بينما الجزيء ذرتان أو أكثر مرتبطة برابطة تساهمية.
2. جزيء - مركب
يتكون الجزيء من ذرات مرتبطة تساهميا، بينما يتكون المركب من عنصرين أو أكثر يرتبطان برابطة تساهمية أو برابطة أيونية.
3. أيون - التمثيل النقطي للإلكترونات
يشير المخطط النقطي للإلكترونات إلى عدد الإلكترونات في المستوى الخارجي للذرة وعند فقد أو اكتساب عدد من الإلكترونات في المستوى الخارجي يتكون الأيون.
4. الصيغة الكيميائية - الجزيء
يتكون الجزيء من ذرات ترتبط تساهمياً يمكن التعبير عنها من خلال الصيغة الكيميائية.
5. الرابطة الأيونية - الرابطة التساهمية
تنشأ الرابطة الأيونية عند اتحاد أيون موجب مع أيون سالب بينما تنشأ الرابطة التساهمية عندما تتشارك ذرتان أو أكثر بعدد معين من الإلكترونات.
6. السحابة الإلكترونية - التمثيل النقطي للإلكترونات
تبين السحابة الإلكترونية المناطق التي تحتلها الإلكترونات المتحركة حول النواة، بينما يشير المخطط النقطي الإلكتروني إلى عدد الإلكترونات في مستوى الطاقة الخارجي للذرة.
7. الرابطة التساهمية - الرابطة القطبية
تعد الرابطة القطبية نوعاً من أنواع الروابط التساهمية حيث يتم المشاركة بالإلكترونات بصورة غير متساوية.
8. المركب - الصيغة الكيميائية
المركب مادة نقية تتكون من عنصرين أو أكثر وتبين الصيغة الكيميائية نوع العناصر التي تكونها وفي أي جزء تقع.
9. الرابطة الأيونية - الرابطة الفلزية
تتكون الرابطة الفلزية بين الذرات الفلزية عند تجمع الإلكترونات بينما تتكون الرابطة الأيونية بين الأيونات المختلفة الشحنة.
اختر رمز الإجابة الصحيحة فيما يأتي:
10. أي مما يأتي يعد جزيئاً تساهمياً:
أ. Cl2
ب. Ne
ج. Na
د. Al
11. ما رقم المجموعة التي لعناصرها مستويات طاقة خارجية مستقرة:
أ. 1
ب. 13
ج. 16
د. 18
12. أي مما يأتي يصف ما يمثله الركز -Cl:
أ. مركب أيوني.
ب. جزيء قطبي.
ج. أيون سالب.
د. أيون موجب.
13. أي المركبات الآتية غير أيونية:
أ. NaF
ب. CO
ج. LiCl
د. MgBr2
14. أي مما يأتي ليس صحيحاً فيما يتعلق بجزيء H2O:
أ. يحوي ذرتي هيدروجين.
ب. يحوي ذرة أوكسجين.
ج. مركب تساهمي قطبي.
د. مركب أيوني.
15. ما الذي يحدث للإلكترونات عند تكوين الرابطة التساهمية القطبية؟
أ. تفقد.
ب. تكتسب.
ج. تتشارك فيها الذرات بشكل متساو (متجانس).
د. تتشارك فيها الذرات بشكل غير متساو (غير متجانس)
16. ما الوحدة الأساسية لتكوين المركبات التساهمية؟
ا. أيونات.
ب. أملاح.
ج. جزيئات.
د. أحماض.
17. ما الذي يدل عليه الرقم 2 الموجود في الصيغة الكيميائية CO2
أ. أيوني أوكسجين-2O2
ب. ذرتي أوكسجين2O
ج. جزيئي CO2
د. مركبيCO2
18. وضح لماذا تكون عناصر المجموعتين 1 و2 وعناصر المجموعتين 16 و17 مركبات كثيرة؟
لأن عناصر المجموعتين 1,2 تفقد إلكتروناً أو اثنين بسهولة، بينما تكتسب عناصر المجموعتين 16,17 إلكتروناً أو اثنين بسهولة.
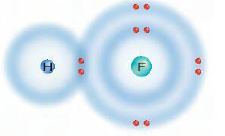
استعن بالرسم التوضيحي الآتي للإجابة عن السؤالين 19 و20.
19. وضح ما نوع الرابطة الكيميائية الموضحة في الرسم؟
رابطة تساهمية، توضح الصورة زوجاً مشتركاً من الإلكترونات بين الهيدروجين والفلور.
20. توقع هل تشاركت الذرتان بالإلكترونات بصورة متساوية أم غير متساوية؟ وأين تكون الإلكترونات معظم الوقت؟
تتشارك الإلكترونات بصورة غير متساوية وتكون الإلكترونات معظم الوقت قرب ذرة الفلور.
21. حلل لماذا ينفصل أيونا الصوديوم والكلور أحدهما عن الآخر عندما يذوب ملح الطعام في الماء؟
لأن الأقطاب الموجبة من جزيء الماء القطبي تنجذب نحو أيون الكلور وتدفعه بعيداً عن المادة الصلبة، بينما تنجذب الأقطاب السالبة من جزيء الماء القطبي نحو أيون الصوديوم وتدفعه بعيداً عن المادة الصلبة أيضاً.
22. وضح لماذا تكون درجة غليان الماء أعلى كثيراً من درجة غليان الجزيئات المشابهة له في الكتلة اعتماداً على حقيقة كون الماء مركباً قطبياً؟
تنجذب الأقطاب السالبة لجزيء الماء نحو الأقطاب الموجبة لجزيئات الماء الأخرى مما يتطلب طاقة إضافية لفصل هذه الجزيئات بعضها عن بعض.
23. توقع لدينا مركبات CuCl وCuCl2 فإذا تحلل كل منهما الى مكوناته الأصلية النحاس والكلور فتوقع أي المركبين السابقين يعطي كمية أكبر من النحاس؟ وضح اجابتك
سيعطي مركب CuCl كمية أكبر من النحاس لأنه يحتوي على كميات أكبر من المركب الثاني CuCl.
24. خريطة مفاهيمية ارسم خريطة مفاهيمية مبتدئاً بمصطلح "الرابطة الكيميائية"، ومستخدماً جميع المفردات الواردة في فقرة "استخدام المفردات".
اعتمد على الشكل الآتي للإجابة عن السؤال رقم 26 في دفتر العلوم.
26. استخدم الجداول املأ العمود الثاني بعدد الذرات الفلزية والعمود الثالث بعدد الذرات اللافلزية.
| المركب | عدد الذرات الفلزية | عدد الذرات اللافلزية |
| Cu2O | 2 | 1 |
| Al2S3 | 2 | 3 |
| NaF | 1 | 1 |
| pbCi4 | 1 | 4 |
27. مستويات الطاقة احسب أقصى عدد من الإلكترونات التي يمكن أن يستوعبها مستوى الطاقة السادس.
72
حلول أسئلة الصف الثالث المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى في موقع موقع سبورة - طلاب السعودية


.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)


النقاشات