حلول الأسئلة
السؤال
لماذا لم تؤثر إلكترونات صفيحة الذهب في تجربة رذرفورد في مسار جسيمات ألفا؟
الحل
الإلكترونات أصفر من أن تؤثر في جسيمات ألفا.
شاهد حلول جميع الاسئلة
الدرس الأول: نماذج الذرة
ما الأشعة المهبطية؟
سيل من الجسيمات الصغيرة ينتج عن القرص المعدني في المهبط ضمن أنبوب الأشعة المهبطية.
ما الجسيمات المنتشرة في نموذج طومسون؟
في نموذج طومسون نجد أن الشحنات السالبة منتشرة حول الشحنات الموجبة.
كيف وصف رذرفورد نموذجه الجديد؟
وصف راذرفورد نموذجه بأنه محاط بفراغ توجد فيه إلكترونات عديمة الكتلة وأن الجزء المركزي الصلب ذو شحنة موجبة.
نموذج الذرة النووية
التحليل:
1. ما الجسيمات المفقودة في النموذج الذي صممته لذرة الأوكسجين؟
الإلكترونات.
2. ما عدد الجسيمات التي من المفترض أن توجد في النموذج؟ وأين يجب أن توضع.
8 إلكترونات توضع في الفراغ حول النواة.
اختبر نفسك
1. فسر كيف يختلف النموذج النووي للذرة عن نموذج الكرة المصمتة؟
في النموذج النووي للذرة تكون جميع الشحنة الموجبة للذرة بالإضافة إلى جميع كتلة الذرة تقريباً موجودة في نواة صغيرة، بينما تحتل الالكترونات المساحة المحيطة بالنواة، أما في نموذج الكرة الصلبة المصمتة للذرة فينص على أن الذرة هي أصغر جزء في المادة يحمل صفاتها.
2. حدد عدد الإلكترونات في ذرة متعادلة تحتوي 49 بروتوناً.
49 إلكتروناً.
3. التفكير الناقد لماذا لم تؤثر إلكترونات صفيحة الذهب في تجربة رذرفورد في مسار جسيمات ألفا؟
الإلكترونات أصفر من أن تؤثر في جسيمات ألفا.
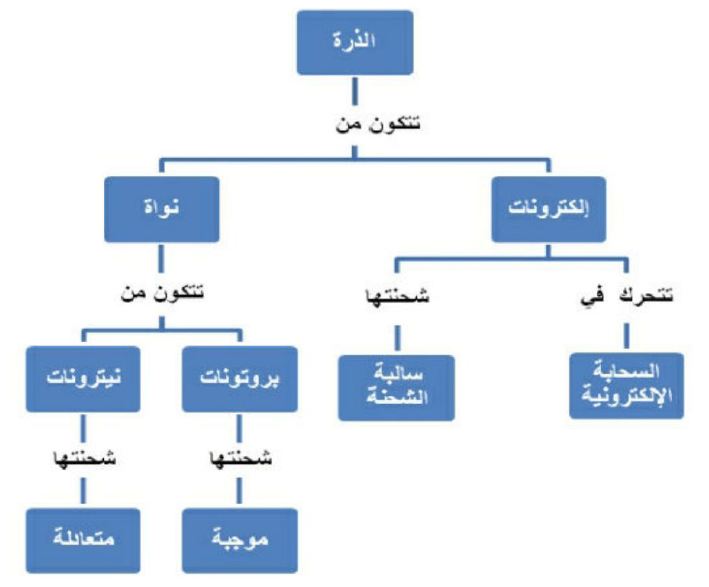
4. خريطة مفاهيمية صمم خريطة مفاهيمية على أن تضع فيها المفردات المتعلقة بنماذج الذرات والتي وردت في هذا الدرس.
5. حل المعادلة بخطوة واحدة إذا علمت أن كتلة الإلكترون تساوي 9.11 ×10-28 جم وان كتلة البروتون تعادل كتلة الإلكترون 1863 مرة فاحسب كتلة البروتون بوحدة الجرام ثم حولها إلى وحدة الكيلو جرام.
(9.11 ×10-28) ×1836.
= 1.67 × 10-24 جم.
= (1.67 × 10-24)×1كجم/1000 جم.
= 1.67 ×10 كجم.


.JPG)
.JPG)
.JPG)
.JPG)